将10g质量分数为20%的氢氧化钠溶液与20g质量分数为10%的硫酸溶液混合后,所得溶液不能与下列物质发生反应的是
A.CuCl2
B.Na2CO3
C.CO2
D.Ba(NO3)2
对258人提供帮助
分析:欲正确解答本题,需根据化学方程式得出各物质之间的质量比,列出比例式,通过计算得出反应后剩余的物质,再据此进行判断.
解答:设参加反应的NaOH的质量为x,
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x 20×10%g
∴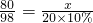
解之得:x≈1.63g<10g×20%,
故硫酸溶液被反应完,氢氧化钠溶液有剩余.
所以反应后所得溶液中有NaOH和Na2SO4,它们与Na2CO3都含有钠元素,不能互相交换成分,故不能发生反应.
故选B.
点评:本题主要考查学生运用化学方程式进行计算的能力.