【题文】(5分)向154.7 g一定质量分数的稀硫酸溶液中放入10.0 g粗锌(含有不溶于稀硫酸的杂质),恰好完全反应,共收集到标准状况下的氢气2.24 L。(锌的相对原子质量为65;标准状况下氢气的密度约为0.09 g/L)计算:(均保留1位小数)
(1)反应产生氢气的质量。
(2)反应结束后,过滤,滤渣的质量。
(3)反应后所得溶液的溶质质量分数。
对258人提供帮助
试题分析:解:(1)反应生成的氢气的质量为:2.24L ×0.09g/L=0.20g
(2)设参加反应的金属锌的质量为X,生成硫酸锌的质量为Y
Zn + H2SO4 ="==" ZnSO4 + H2↑
65 161 2
X Y 0.2g
65:2=X:0.2g 161:2=Y:0.2g
X=6.5g Y=16.1g
反应结束后,过滤,滤渣的质量为:10.0g-6.5g==3.5g
(3)反应后溶液的质量为154.7g+10g-3.5g-0.2g=161.0g
反应后所得溶液的溶质质量分数为: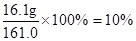
答:反应生成的氢气的质量0.2g; 反应结束后,过滤,滤渣的质量为3.5g; 反应后所得溶液的溶质质量分数为10%
考点:根据化学方程式的计算