【题文】(5分)下表是KNO3 、NaCl在不同温度下的溶解度:
温度(℃)
0
10
20
30
40
50
60
70
80
90
100
溶解度/g
KNO3
13.3
20.9
32
45.8
64
85.5
110
138
169
202
246
NaCl
35.7
35.8
36
36.3
36.6
37
37.3
37.8
38.4
39
39.8
(1)将20℃时相同质量的KNO3 、NaCl饱和溶液冷却至0℃,析出晶体多的是 。
(2) 60℃时,将50g硝酸钾固体投入50g水中,充分溶解后可得到硝酸钾 溶液(填“不饱和”或“饱和”或“不能确定”)。将温度降到20℃,计算溶液中溶质的质量分数 (精确到0.1%)。
(3)将20℃时KNO3和NaCl的饱和溶液同时升高一定温度后,所得溶液中溶质的质量分数的大小关系是:硝酸钾 氯化钠(填“>”或“<”或“=”)。
对258人提供帮助
试题分析:由KNO3 、NaCl在不同温度下的溶解度可知,(1)将20℃时相同质量的KNO3 、NaCl饱和溶液冷却至0℃,析出晶体多的是KNO3(2) 60℃时,将50g硝酸钾固体投入50g水中,充分溶解后可得到硝酸钾不饱和溶液,因为60℃时其溶解度为110g,故50g水溶解55g硝酸钾才能饱和;将温度降到20℃,溶液中溶质的质量分数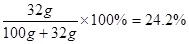 ;因为二者的溶解度度随温度的升高而增大,故不会有晶体析出,所以所得溶液中溶质的质量分数的大小关系是起始的浓度的大小关系,故硝酸钾<氯化钠
;因为二者的溶解度度随温度的升高而增大,故不会有晶体析出,所以所得溶液中溶质的质量分数的大小关系是起始的浓度的大小关系,故硝酸钾<氯化钠
考点:溶解度及其计算